La oncocercosis, también conocida como ceguera del río, es una enfermedad causada por la infección con el gusano parasitario Onchocerca vólvulos. Los síntomas incluyen picor intenso, protuberancias debajo de la piel y ceguera. Es la segunda causa más común de ceguera debido a una infección, después del tracoma.
El gusano parásito se propaga por las mordeduras de una mosca negra del tipo Simulium. Por lo general, se requieren muchas mordeduras antes de que ocurra la infección. Estas moscas viven cerca de los ríos, de ahí el nombre común de la enfermedad.
Una vez dentro de una persona, las lombrices crean larvas que se abren camino hasta la piel, donde pueden infectar a la siguiente mosca negra que muerde a la persona. Hay varias maneras de hacer el diagnóstico, incluyendo: colocar una biopsia de la piel en solución salina normal y vigilar que la larva salga, buscar larvas en el ojo y buscar gusanos adultos en las protuberancias debajo de la piel.
No existe una vacuna contra la enfermedad. La prevención consiste en evitar las picaduras de moscas, lo que puede incluir el uso de repelentes de insectos y ropa adecuada. Otros esfuerzos incluyen los destinados a reducir la población de moscas mediante la fumigación con insecticidas.
En varias zonas del mundo se están realizando esfuerzos para erradicar la enfermedad mediante el tratamiento de grupos enteros de personas dos veces al año. El tratamiento de las personas infectadas es con el medicamento ivermectina cada seis a doce meses. Este tratamiento mata a las larvas pero no a los gusanos adultos. El antibiótico doxiciclina debilita a los gusanos al matar a una bacteria asociada llamada Wolbachia, y algunos también lo recomiendan[4] Los bultos debajo de la piel también pueden extirparse por medio de cirugía.
Alrededor de 15,5 millones de personas están infectadas con la ceguera del río. Aproximadamente 0,8 millones tienen alguna pérdida de visión a causa de la infección. La mayoría de las infecciones ocurren en el África subsahariana, aunque también se han reportado casos en Yemen y en áreas aisladas de América Central y del Sur.
En 1915, el médico Rodolfo Robles relacionó por primera vez al gusano con la enfermedad de los ojos. La Organización Mundial de la Salud (OMS) lo incluyó en la lista de enfermedades tropicales desatendidas.
Historia
Onchocerca es originaria de África y fue exportada a las Américas por la trata de esclavos, como parte del intercambio colombiano que introdujo otras enfermedades del viejo mundo como la fiebre amarilla en el Nuevo Mundo. Los hallazgos de un estudio filogenético a mediados de la década de los 90 son consistentes con una introducción al Nuevo Mundo de esta manera.
Las secuencias de ADN de las cepas de sabana y de la selva tropical en África difieren, mientras que las cepas americanas son idénticas a las cepas de sabana en África occidental. El parásito microfilárico que causa la enfermedad fue identificado por primera vez en 1874 por un cirujano naval irlandés, John O’Neill, que buscaba identificar la causa de una enfermedad común de la piel a lo largo de la costa occidental de África, conocida como “craw-craw”.
Rudolf Leuckart, un zoólogo alemán, examinó más tarde especímenes del mismo gusano filario enviado desde África por un médico misionero alemán en 1890 y llamó al organismo Filaria vólvulos.
Rodolfo Robles y Rafael Pacheco en Guatemala mencionaron por primera vez la forma ocular de la enfermedad en las Américas hacia 1915. Describieron una infección de lombriz tropical con Onchocerca adulta que incluía inflamación de la piel, especialmente de la cara (‘erisipela de la costa’), y de los ojos.
La enfermedad, comúnmente llamada “enfermedad de la ceguera filaria”, y más tarde conocida como “enfermedad de Robles”, era común entre los trabajadores de las plantaciones de café. Las manifestaciones incluyeron nódulos subcutáneos, lesiones oculares anteriores y dermatitis.
Robles envió especímenes a Émile Brumpt, un parasitólogo francés, quien lo nombró O. caecutiens en 1919, indicando que el parásito causaba ceguera (en latín “caecus” que significa ciego). También se informó que la enfermedad era común en México[55] A principios de la década de 1920, se acordó en general que la filaria en África y América Central era morfológicamente indistinguible y que era igual a la descrita por O’Neill 50 años antes.
Robles planteó la hipótesis de que el vector de la enfermedad era la mosca negra de mordedura diurna, Simulium. El médico escocés Donald Blacklock, de la Escuela de Medicina Tropical de Liverpool, confirmó este modo de transmisión en estudios realizados en Sierra Leona.
Los experimentos de Blacklock incluyeron la reinfección de moscas Simulium expuestas a porciones de la piel de sujetos infectados en las que había nódulos, lo que condujo a la elucidación del ciclo de vida del parásito Onchocerca.
Blacklock y otros no pudieron encontrar evidencia de enfermedad ocular en África. Jean Hissette, oftalmólogo belga, descubrió en 1930 que el organismo era la causa de una “ceguera del río” en el Congo belga. Algunos de los pacientes reportaron haber visto hilos enredados o gusanos en su visión, que eran microfilarias que se movían libremente en el humor acuoso de la cámara anterior del ojo.
Blacklock y Strong habían pensado que el gusano africano no afectaba los ojos, pero Hissette informó que el 50% de los pacientes con oncocercosis cerca del río Sankuru en el Congo Belga tenían enfermedad ocular y el 20% eran ciegos.
Hisette aisló las microfilarias de un ojo enucleado y describió la típica cicatriz coriorretiniana, más tarde llamada “fondo de ojo Hissette-Ridley”, en honor a otro oftalmólogo Harold Ridley, quien también realizó extensas observaciones sobre pacientes con oncocercosis en el noroeste de Ghana, publicando sus hallazgos en 1945. Ridley postuló por primera vez que la enfermedad había sido causada por la trata de esclavos.
La comunidad científica internacional se mostró inicialmente escéptica ante los hallazgos de Hisette, pero fueron confirmados por la Expedición Africana de Harvard de 1934, dirigida por Richard P. Strong, un médico estadounidense de medicina tropical.
También te puede interesar: Pénfigo Paraneoplásico: Causas, Síntomas, Diagnostico, Tratamiento
Signos y síntomas
Los gusanos adultos permanecen en nódulos subcutáneos, lo que limita el acceso al sistema inmunológico del huésped, mientras que las microfilarias, en cambio, son capaces de inducir respuestas inflamatorias intensas, especialmente tras su muerte. Se ha descubierto que las especies de Wolbachia son endosimbiontes de O. vólvulos adultos y microfilarias, y se cree que son la fuerza motriz detrás de la mayor parte de la morbilidad de O. vólvulos.
Recientemente se ha descubierto que las microfilarias moribundas liberan la proteína de superficie de Wolbachia que activa la TLR2 y la TLR4, desencadenando respuestas inmunitarias innatas y produciendo la inflamación y su morbilidad asociada. La gravedad de la enfermedad es directamente proporcional al número de microfilarias infectadas y al poder de la respuesta inflamatoria resultante.
El compromiso de la piel típicamente consiste en picazón, hinchazón e inflamación intensas. Se ha desarrollado un sistema de clasificación para categorizar el grado de compromiso de la piel:
- Papular aguda: pápulas pruriginosas dispersas
- Papular crónica: pápulas más grandes, lo que resulta en hiperpigmentación.
- Liquenificada – pápulas y placas hiperpigmentadas: con edema, linfadenopatía, prurito e infecciones bacterianas secundarias comunes.
- Atrofia cutánea: pérdida de elasticidad, la piel se asemeja al papel de seda, apariencia de piel de lagarto
- Despigmentación: apariencia de piel de leopardo’, generalmente en la parte inferior anterior de la pierna
- Efecto de glaucoma: mal funcionamiento de los ojos, empiezan a ver sombras o nada.
- El compromiso ocular proporciona el nombre común asociado con la oncocercosis, la ceguera de los ríos y puede afectar a cualquier parte del ojo desde la conjuntiva y la córnea hasta la uvea y el segmento posterior, incluyendo la retina y el nervio óptico.
Las microfilarias migran a la superficie de la córnea. La queratitis puntual se presenta en el área infectada. Esto desaparece a medida que la inflamación disminuye. Sin embargo, si la infección es crónica, puede ocurrir queratitis esclerosante, haciendo que el área afectada se vuelva opaca. Con el tiempo, toda la córnea puede volverse opaca, lo que lleva a la ceguera. Algunas evidencias sugieren que el efecto sobre la córnea es causado por una respuesta inmune a las bacterias presentes en los gusanos.
La piel pica, con sarpullidos severos que dañan permanentemente los parches de piel.
Reacción de Mazzotti
La reacción de Mazzotti, descrita por primera vez en 1948, es un complejo de síntomas que se observa en pacientes después de recibir tratamiento para la oncocercosis con el medicamento dietilcarbamazina (DEC).
Las reacciones de Mazzotti pueden ser potencialmente mortales y se caracterizan por fiebre, urticaria, ganglios linfáticos inflamados y sensibles, taquicardia, hipotensión, artralgias, edema y dolor abdominal que ocurren dentro de los siete días posteriores al tratamiento de la microfilariasis.
Prueba de parches
El fenómeno es tan común cuando se usa DEC que este medicamento es la base de una prueba de parche cutáneo utilizada para confirmar ese diagnóstico. El parche farmacológico se coloca en la piel, y si el paciente está infectado con O. vólvulos microfilaria, se observan prurito localizado y urticaria en el lugar de la aplicación.
Enfermedad de la cabeza
Esta es una forma inusual de epilepsia epidémica asociada con la oncocercosis, aunque no se ha establecido una relación definitiva. Este síndrome fue descrito por primera vez en Tanzania por Louise Jilek-Aall, una doctora psiquiátrica noruega en la práctica tanzaniana, durante la década de 1960.
Ocurre con mayor frecuencia en Uganda y el sur de Sudán. Se manifiesta en niños de 5 a 15 años de edad que antes estaban sanos, a menudo se desencadena por la alimentación o las bajas temperaturas y va acompañada de deterioro cognitivo. Las convulsiones ocurren con frecuencia y pueden ser difíciles de controlar.
El electroencefalograma es anormal, pero el líquido cefalorraquídeo (LCR) y la resonancia magnética (IRM) son normales o muestran cambios no específicos. Si hay anormalidades en la resonancia magnética, generalmente están presentes en el hipocampo. La prueba de reacción en cadena de la polimerasa del LCR no muestra la presencia del parásito.
Clasificación
La oncocercosis causa diferentes tipos de cambios en la piel, que varían en diferentes regiones geográficas; puede dividirse en las siguientes fases o tipos:
Erisipela de la costa
Una fase aguda, se caracteriza por la hinchazón de la cara, con eritema y picor. Este cambio de piel, erisípela de la costa, de la oncocercosis aguda es más común entre las víctimas en América Central y del Sur.
Mal morando
Esta condición cutánea se caracteriza por una inflamación acompañada de hiperpigmentación.
Sowda
Es una afección cutánea, es un tipo localizado de oncocercosis.
Cambios
Los diversos cambios en la piel asociados con la oncocercosis se pueden describir de la siguiente manera:
Piel de leopardo
La despigmentación manchada de la piel que puede ocurrir con la oncocercosis.
Piel de elefante
El engrosamiento de la piel humana que puede estar asociado con la oncocercosis.
Piel de lagarto
La piel engrosada y arrugada cambia que puede resultar en oncocercosis.
Causa de la oncocercosis
La causa es Onchocerca vólvulos.
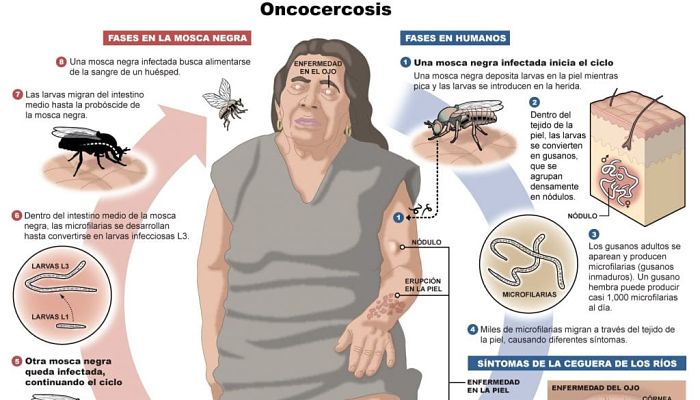
Ciclo de vida
- La vida del parásito puede ser rastreada a través de la mosca negra y los huéspedes humanos en los siguientes pasos:
- Una mosca negra hembra de Simulium toma una comida de sangre en un huésped humano infectado e ingiere microfilarias.
- Las microfilarias entran en los músculos de vuelo intestinal y torácico de la mosca negra, progresando hacia el primer estadio larvario (J1.).
- Las larvas maduran en el segundo estadio larvario (J2.), y se trasladan a la probóscide y a la saliva en su tercer estadio larvario (J3.). La maduración dura unos siete días.
- La mosca negra toma otra comida de sangre, pasando las larvas a la sangre del siguiente huésped humano.
- Las larvas migran al tejido subcutáneo y se someten a dos mudas más. Forman nódulos a medida que maduran hasta convertirse en gusanos adultos en un período de seis a 12 meses.
- Después de madurar, los gusanos machos adultos se aparean con gusanos hembras en el tejido subcutáneo para producir entre 700 y 1.500 microfilarias por día.
- La microfilaria migra a la piel durante el día, y las moscas negras sólo se alimentan durante el día, por lo que el parásito se encuentra en una posición privilegiada para que la mosca hembra lo ingiera. Las moscas negras toman comidas con sangre para ingerir estas microfilarias y reiniciar el ciclo.
Prevención
Varios programas de control tienen como objetivo evitar que la oncocercosis sea un problema de salud pública. El primero fue el Programa de Control de la Oncocercosis (OCP), que se puso en marcha en 1974, y que en su punto álgido abarcó a 30 millones de personas en 11 países.
Mediante la fumigación con larvicidas de los ríos de flujo rápido para controlar las poblaciones de mosca negra y, a partir de 1988, el uso de ivermectina para tratar a las personas infectadas, el OCP eliminó la oncocercosis como un problema de salud pública.
El OCP, un esfuerzo conjunto de la Organización Mundial de la Salud, el Banco Mundial, el Programa de las Naciones Unidas para el Desarrollo y la Organización de las Naciones Unidas para la Agricultura y la Alimentación, fue considerado un éxito, y llegó a su fin en 2002. El monitoreo continuo asegura que la oncocercosis no pueda reinvadir el área del ACO.
En 1995, el Programa Africano para el Control de la Oncocercosis comenzó a cubrir otros 19 países, basándose principalmente en el uso de ivermectina. Su objetivo es establecer un suministro de ivermectina dirigido a la comunidad para las personas infectadas. En 2015, la OMS estaba facilitando el lanzamiento de un programa de eliminación en Yemen.
El 29 de julio de 2013, la Organización Panamericana de la Salud (OPS) anunció que después de 16 años de esfuerzos, Colombia se había convertido en el primer país del mundo en eliminar la oncocercosis.
En septiembre de 2015, el Programa de Eliminación de la Oncocercosis para las Américas anunció que la oncocercosis sólo permanecía en una región remota en la frontera entre Brasil y Venezuela, donde vive el pueblo indígena yanomami. Los primeros países en recibir la verificación de la eliminación fueron Colombia en 2013, Ecuador en 2014 y México en 2015.
Guatemala ha presentado una solicitud de verificación. El factor clave en la eliminación es la administración masiva del medicamento antiparasitario ivermectina. La proyección inicial era que la enfermedad sería eliminada de los focos restantes en las Américas para 2012.
No hay ninguna vacuna disponible para prevenir la infección por oncocercosis en humanos. Una vacuna para prevenir la infección por oncocercosis en el ganado se encuentra en la fase tres de los ensayos.
Los bovinos inyectados con una forma modificada y debilitada de larvas de O. ochengi han desarrollado niveles muy altos de protección contra la infección. Los hallazgos sugieren que podría ser posible desarrollar una vacuna que proteja a las personas contra la ceguera del río usando un enfoque similar. Desafortunadamente, una vacuna para proteger a los humanos aún está a muchos años de distancia.
Tratamiento
La carga de la oncocercosis: niños que dirigen a adultos ciegos en África. En los programas de administración masiva de medicamentos (MDA), el tratamiento para la oncocercosis es ivermectina (nombre comercial: Mectizan); las personas infectadas pueden ser tratadas con dos dosis de ivermectina, con seis meses de diferencia, que se repiten cada tres años.
La droga paraliza y mata las microfilarias causando fiebre, picor, y posiblemente edema, artritis y linfadenopatía. El picor intenso de la piel se alivia con el tiempo y se detiene la progresión hacia la ceguera. Además, aunque el medicamento no mata a los gusanos adultos, sí les impide, por un tiempo limitado, producir descendencia adicional. Por lo tanto, el fármaco previene tanto la morbilidad como la transmisión durante varios meses.
El tratamiento con ivermectina es particularmente efectivo porque sólo necesita ser tomado una o dos veces al año, no necesita refrigeración y tiene un amplio margen de seguridad, con el resultado de que ha sido ampliamente administrado por trabajadores comunitarios de la salud mínimamente capacitada.
Antibióticos
Para el tratamiento de los individuos, la doxiciclina se utiliza para matar la bacteria Wolbachia que vive en los gusanos adultos. Se ha demostrado que este tratamiento complementario reduce significativamente la carga microfilárica en el huésped y puede matar a los gusanos adultos, debido a la relación simbiótica entre Wolbachia y el gusano.
En cuatro ensayos separados durante diez años con varios regímenes de dosificación de doxiciclina para el tratamiento individualizado, se encontró que la doxiciclina es eficaz para esterilizar a los gusanos femeninos y reducir su número durante un período de cuatro a seis semanas.
La investigación sobre otros antibióticos, como la rifampicina, ha demostrado su eficacia en modelos animales para reducir la Wolbachia tanto como alternativa como complemento de la doxiciclina. Sin embargo, el tratamiento con doxiciclina requiere una dosis diaria durante al menos cuatro a seis semanas, lo que hace más difícil su administración en las zonas afectadas.
Ivermectina
La ivermectina mata al parásito interfiriendo con el sistema nervioso y la función muscular, en particular, aumentando la neurotransmisión inhibitoria. Estos canales, presentes en las neuronas y los miocitos, no son específicos de los invertebrados, sino que están protegidos en los vertebrados de la acción de la ivermectina por la barrera hematoencefálica.
Se cree que la ivermectina activa irreversiblemente estos receptores de canal en el gusano, lo que finalmente causa un potencial inhibitorio postsináptico. La probabilidad de que ocurra una acción potencial futura en las sinapsis entre neuronas disminuye y los nematodos experimentan una parálisis flácida seguida de la muerte.
La ivermectina es directamente eficaz contra las microfilarias en estado larvario de O. vólvulos; están paralizadas y pueden ser eliminadas por eosinófilos y macrófagos. No mata a las hembras adultas (macrofilarias), pero hace que dejen de liberar microfilarias, quizás paralizando el tracto reproductivo.
La ivermectina es muy eficaz para reducir la carga microfilárica y reducir el número de opacidades punzantes en individuos con oncocercosis.

Dermatologa. Especialista en enfermedades de la piel, pelo y uñas.